如果你也在 怎样代写无机化学inorganic chemistry这个学科遇到相关的难题,请随时右上角联系我们的24/7代写客服。无机化学inorganic chemistry涉及到无机和有机金属化合物的合成和行为。这个领域涵盖了非碳基的化合物,这些化合物是有机化学的主题。这两门学科之间的区别远非绝对,因为有机金属化学的分支学科有很多重叠。它在化学工业的各个方面都有应用,包括催化、材料科学、颜料、表面活性剂、涂料、药物、燃料和农业。
无机化学inorganic chemistry许多无机化合物是离子化合物,由阳离子和阴离子通过离子键连接组成。盐(属于离子化合物)的例子有氯化镁MgCl2,它由镁的阳离子Mg2+和氯的阴离子Cl-组成;或氧化钠Na2O,它由钠的阳离子Na+和氧化阴离子O2-组成。在任何盐中,离子的比例是这样的:电荷相互抵消,因此大部分化合物是电中性的。离子由其氧化状态描述,其形成的难易程度可以从电离电位(阳离子)或从母元素的电子亲和力(阴离子)推断出来。
my-assignmentexpert™ 无机化学inorganic chemistry作业代写,免费提交作业要求, 满意后付款,成绩80\%以下全额退款,安全省心无顾虑。专业硕 博写手团队,所有订单可靠准时,保证 100% 原创。my-assignmentexpert™, 最高质量的无机化学inorganic chemistry作业代写,服务覆盖北美、欧洲、澳洲等 国家。 在代写价格方面,考虑到同学们的经济条件,在保障代写质量的前提下,我们为客户提供最合理的价格。 由于统计Statistics作业种类很多,同时其中的大部分作业在字数上都没有具体要求,因此无机化学inorganic chemistry作业代写的价格不固定。通常在经济学专家查看完作业要求之后会给出报价。作业难度和截止日期对价格也有很大的影响。
想知道您作业确定的价格吗? 免费下单以相关学科的专家能了解具体的要求之后在1-3个小时就提出价格。专家的 报价比上列的价格能便宜好几倍。
my-assignmentexpert™ 为您的留学生涯保驾护航 在化学Chemical作业代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的无机化学inorganic chemistry代写服务。我们的专家在化学Chemical代写方面经验极为丰富,各种无机化学inorganic chemistry相关的作业也就用不着 说。
我们提供的无机化学inorganic chemistry及其相关学科的代写,服务范围广, 其中包括但不限于:
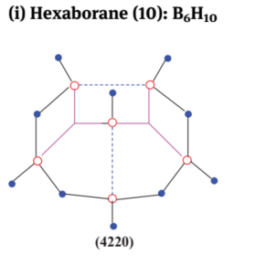
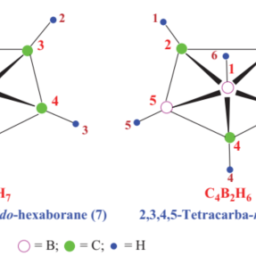
化学代写|无机化学作业代写INORGANIC CHEMISTRY代考|Bonding in boranes and higher boranes/boron clusters: molecular orbital approach
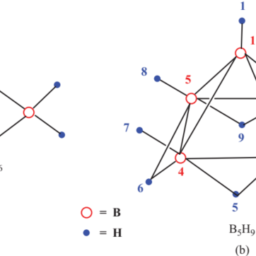
The bonding in Boranes may be explained on the basis of an idea of $3 \mathrm{c}-2 \mathrm{e} \mathrm{B}-\mathrm{H}-\mathrm{B}$ and B-B-B types of bond proposed by H. C. Longuet-Higgins in 1943. As an undergraduate, he proposed the correct structure of the chemical compound diborane $\left(\mathrm{B}{2} \mathrm{H}{6}\right)$, which was then unknown because it turned out to be different from structures in contemporary chemical structures in contemporary chemical valence theory. This was published in 1943 with his tutor, R. P. Bell (Longuet-Higgins and Bell 1943). This idea was later on refined by W. N. Lipscomb.
化学代写|无机化学作业代写inorganic chemistry代考|Molecular orbital approach
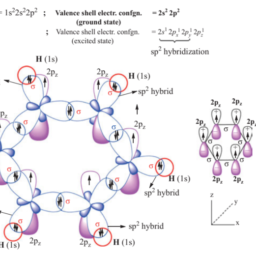
In simple MO theory of covalent bonding, two AOs of the same symmetry and almost similar energy linearly combine with each other to give rise two MOs (bonding and anti-bonding) by the linear combination of atomic orbitals method. Similarly, three AOs of same symmetry and similar energy combine linearly and would give three MOs (number of MOs is always equal to the number of atomic orbitals combine).
化学代写|无机化学作业代写INORGANIC CHEMISTRY代考|Formation of B–H–B bond
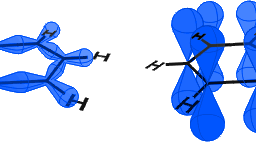
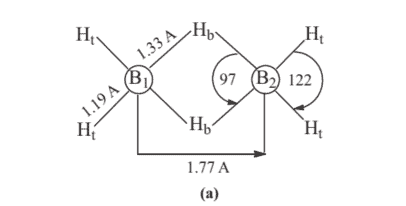
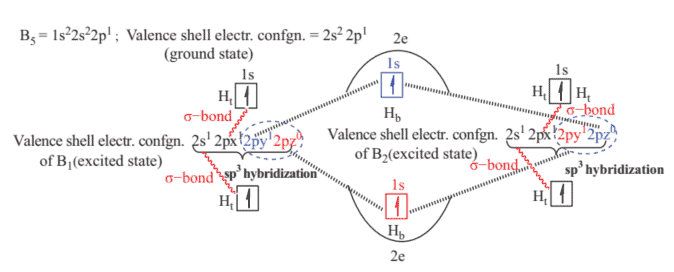
As the attachment with each of the boron atom in borane is 4 (Figure $3.11(a)$ ), $\mathrm{sp}^{3}$ hybridization may be assumed in the formation of $\mathrm{B}{2} \mathrm{H}{6}$. Of the four $\mathrm{sp}^{3}$ hybrid orbitals on each boron atom, two are used in the formation of two terminal $\mathrm{B}-\mathrm{H}{\mathrm{t}}$ bonds. The rest two $\mathrm{sp}^{3}$ hybrid orbitals on each boron atom along with 1 s atomic orbital of two hydrogen atoms, will now be utilized in the formation of two sets of B-H-B bonds. It is notable here that each $\mathrm{B}-\mathrm{H}-\mathrm{B}$ bond has only two electrons [one electron from one $\mathrm{sp}^{3}$ hybrid orbital of boron ( $2 \mathrm{nd} \mathrm{sp}^{3}$ hybrid orbital is empty) and one electron from 1 s atomic orbital of bridging hydrogen, $\mathrm{H}{\mathrm{b}}$ ] (Figure $3.11(\mathrm{~b})$ ).
无机化学代写
化学代写|无机化学作业代写INORGANIC CHEMISTRY代考|BONDING IN BORANES AND HIGHER BORANES/BORON CLUSTERS: MOLECULAR ORBITAL APPROACH
硼烷中的键合可以基于以下概念来解释3C−2和乙−H−乙和 BBB 型键由 HC Longuet-Higgins 于 1943 年提出。在本科时,他提出了化合物乙硼烷 $\left(\mathrm{B} {2} \mathrm{H} {6}\right的正确结构)$,当时未知,因为它与当代化学价理论中的当代化学结构不同。这是 1943 年与他的导师 RP Bell 一起出版的大号这nG你和吨−H一世GG一世ns一种nd乙和一世一世1943. 这个想法后来被 WN Lipscomb 改进。
化学代写|无机化学作业代写INORGANIC CHEMISTRY代考|MOLECULAR ORBITAL APPROACH
在简单的共价键 MO 理论中,两个具有相同对称性和几乎相似能量的 AOs 彼此线性结合产生两个 MOsb这nd一世nG一种nd一种n吨一世−b这nd一世nG通过原子轨道的线性组合方法。类似地,三个具有相同对称性和相似能量的 AO 线性组合并会产生三个 MOn你米b和r这F米这s一世s一种一世在一种是s和q你一种一世吨这吨H和n你米b和r这F一种吨这米一世C这rb一世吨一种一世sC这米b一世n和.
化学代写|无机化学作业代写INORGANIC CHEMISTRY代考|FORMATION OF B–H–B BOND
由于与硼烷中每个硼原子的连接为 4 (Figure $3.11(a)$ ), $\mathrm{sp}^{3}$ hybridization may be assumed in the formation of $\mathrm{B}{2} \mathrm{H}{6}$. Of the four $\mathrm{sp}^{3}$ hybrid orbitals on each boron atom, two are used in the formation of two terminal $\mathrm{B}-\mathrm{H}{\mathrm{t}}$ bonds. The rest two $\mathrm{sp}^{3}$ hybrid orbitals on each boron atom along with 1 s atomic orbital of two hydrogen atoms, will now be utilized in the formation of two sets of B-H-B bonds. It is notable here that each $\mathrm{B}-\mathrm{H}-\mathrm{B}$ bond has only two electrons [one electron from one $\mathrm{sp}^{3}$ hybrid orbital of boron ( $2 \mathrm{nd} \mathrm{sp}^{3}$ hybrid orbital is empty) and one electron from 1 s atomic orbital of bridging hydrogen, $\mathrm{H}{\mathrm{b}}$ ] (Figure $3.11(\mathrm{~b})$ ).

物化学代写|无机化学作业代写inorganic chemistry代考 请认准UprivateTA™. UprivateTA™为您的留学生涯保驾护航。