如果你也在 怎样代写热力学Thermodynamics MAE204这个学科遇到相关的难题,请随时右上角联系我们的24/7代写客服。热力学Thermodynamics是物理学的一个分支,涉及热、功和温度,以及它们与能量、熵以及物质和辐射的物理特性的关系。这些数量的行为受热力学四大定律的制约,这些定律使用可测量的宏观物理量来传达定量描述,但可以用统计力学的微观成分来解释。热力学适用于科学和工程中的各种主题,特别是物理化学、生物化学、化学工程和机械工程,但也适用于其他复杂领域,如气象学。
热力学Thermodynamics从历史上看,热力学的发展源于提高早期蒸汽机效率的愿望,特别是通过法国物理学家萨迪-卡诺(1824年)的工作,他认为发动机的效率是可以帮助法国赢得拿破仑战争的关键。苏格兰-爱尔兰物理学家开尔文勋爵在1854年首次提出了热力学的简明定义,其中指出:”热力学是关于热与作用在身体相邻部分之间的力的关系,以及热与电的关系的课题。” 鲁道夫-克劳修斯重述了被称为卡诺循环的卡诺原理,为热学理论提供了更真实、更健全的基础。他最重要的论文《论热的运动力》发表于1850年,首次提出了热力学的第二定律。1865年,他提出了熵的概念。1870年,他提出了适用于热的维拉尔定理。
热力学Thermodynamics代写,免费提交作业要求, 满意后付款,成绩80\%以下全额退款,安全省心无顾虑。专业硕 博写手团队,所有订单可靠准时,保证 100% 原创。最高质量的热力学Thermodynamics作业代写,服务覆盖北美、欧洲、澳洲等 国家。 在代写价格方面,考虑到同学们的经济条件,在保障代写质量的前提下,我们为客户提供最合理的价格。 由于作业种类很多,同时其中的大部分作业在字数上都没有具体要求,因此热力学Thermodynamics作业代写的价格不固定。通常在专家查看完作业要求之后会给出报价。作业难度和截止日期对价格也有很大的影响。
同学们在留学期间,都对各式各样的作业考试很是头疼,如果你无从下手,不如考虑my-assignmentexpert™!
my-assignmentexpert™提供最专业的一站式服务:Essay代写,Dissertation代写,Assignment代写,Paper代写,Proposal代写,Proposal代写,Literature Review代写,Online Course,Exam代考等等。my-assignmentexpert™专注为留学生提供Essay代写服务,拥有各个专业的博硕教师团队帮您代写,免费修改及辅导,保证成果完成的效率和质量。同时有多家检测平台帐号,包括Turnitin高级账户,检测论文不会留痕,写好后检测修改,放心可靠,经得起任何考验!
想知道您作业确定的价格吗? 免费下单以相关学科的专家能了解具体的要求之后在1-3个小时就提出价格。专家的 报价比上列的价格能便宜好几倍。
我们在物理Physical代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的物理Physical代写服务。我们的专家在电磁学Electromagnetism代写方面经验极为丰富,各种电磁学Electromagnetism相关的作业也就用不着说。
物理代写|热力学代写Thermodynamics代考|Chemical Potential and Partial Molar Properties
The chemical potential belongs to the group of partial molar properties, and is useful for evaluating miscibility, and the effects on phase transitions (melting and evaporation) and osmotic pressure caused by the composition of solutions. The symbol of chemical potential is $\mu$ and the unit is joule per mole, $\mathrm{J} \mathrm{mol}^{-1}$, which demonstrates that $\mu$ is an intensive property (i.e. a property that is not dependent on the system size). The chemical potential can be defined with respect to $G$; the chemical potential $\mu_{\mathrm{x}}$ is the partial derivative of $G$ with respect to the number of moles of compound $\mathrm{x}\left(n_{\mathrm{x}}\right)$ in a solution based on compound $\mathrm{x}$ and other compounds while keeping constant $T$ and $p$ and the number of moles of the other compounds.
Figure $5.1$ shows two different binary systems. The insertion of an A-molecule into the two solutions has different impacts on the local potential energies depending on the compositions of the solutions. In the case of a pristine B system (Fig. 5.1a), the A-molecule only interacts with B-molecules, whereas in the other system, the inserted A-molecule interacts with both A-and B-molecules (Fig. 5.1b). This shows that the chemical potential of A (denoted $\mu_{\mathrm{A}}$ ) is composition-dependent. The chemical potentials of the two compounds $\left(\mu_{\mathrm{A}}\right.$ and $\left.\mu_{\mathrm{B}}\right)$ in a binary solution can be defined in terms of the partial derivatives of $G$ according to:
$$
\mu_{\mathrm{A}}=\left(\frac{\partial G}{\partial n_{\mathrm{A}}}\right){T, p, n{\mathrm{B}}} \wedge \mu_{\mathrm{B}}=\left(\frac{\partial G}{\partial n_{\mathrm{B}}}\right){T, p, n{\mathrm{A}}}
$$
The total differential of the Gibbs free energy $(d G)$ is thus given (cf. Chap. 4; Eq. (4.4)) by:
$$
d G=-S d T+V d p+\mu_{\mathrm{A}} d n_{\mathrm{A}}+\mu_{\mathrm{B}} d n_{\mathrm{B}}
$$
which means that
$$
G=f\left(T, p, n_{\mathrm{A}}, n_{\mathrm{B}}\right)
$$
The chemical potential of $\mathrm{A}\left(\mu_{\mathrm{A}}\right)$ can also be defined from the other state functions according to Chap. 4, Eqs. (4.1, 4.2, and 4.3):
$$
\mu_{\mathrm{A}}=\left(\frac{\partial U}{\partial n_{\mathrm{A}}}\right){S, V, n{\mathrm{B}}} \wedge \mu_{\mathrm{A}}=\left(\frac{\partial H}{\partial n_{\mathrm{A}}}\right){S, p, n{\mathrm{B}}} \wedge \mu_{\mathrm{A}}=\left(\frac{\partial A}{\partial n_{\mathrm{A}}}\right){T, V, n{\mathrm{B}}}
$$
which shows that:
$$
U=f\left(S, V, n_{\mathrm{A}}, n_{\mathrm{B}}\right) \wedge H=f\left(S, p, n_{\mathrm{A}}, n_{\mathrm{B}}\right) \wedge A=f\left(T, V, n_{\mathrm{A}}, n_{\mathrm{B}}\right)
$$
At constant $T$ and constant $p$, the following expression obeys:
$$
G=n_{\mathrm{A}} \mu_{\mathrm{A}}+n_{\mathrm{B}} \mu_{\mathrm{B}}
$$
物理代写|热力学代写Thermodynamics代考|One-Component Systems: Transitions and Phase Diagrams
This chapter deals with phases and phase transitions of pure compounds. A phase is a physically distinct form of matter, either of a pure substance or of a mixture of several substances. Examples of such phases are solids, liquids and gases. There are several possible solid phases for a given substance: different crystal phases (polymorphism) and glass. Liquid phases can in the case of mixtures coexist in different compositional forms. Thermodynamics deals with equilibrium states, and the phase diagrams that will be dealt with are obtained from such considerations. A phase diagram presents a convenient map showing where (i.e. at which $T, p$ and composition) the different phases are thermodynamically stable. For pure substances, the composition is not an issue. The real structures formed may not however match the phase diagram; the kinetics often play a decisive role. However, the complexity of the kinetics is barely touched upon in the current text
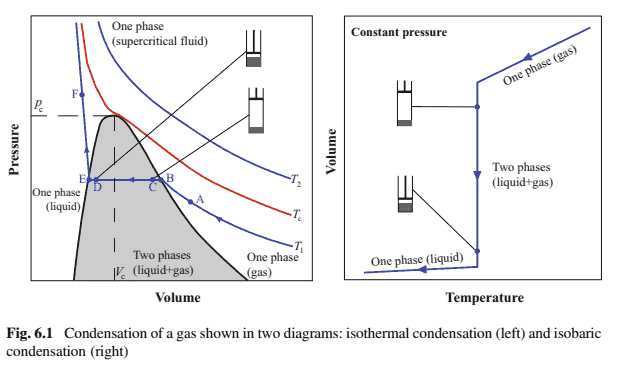
A phase transition from gas to liquid (condensation) is illustrated in Fig. 6.1, a phase diagram which shows the presence of different phases in $p-V$ space. A third state function is also present, temperature $(T)$. The lines in the $p V$-diagram indicate isotherms.
Let us follow the isotherm (at $T_1$ ) in the left-hand graph. The pressure is gradually increased by applying a force on the piston. The pressured volume is only a gas at point A. The ideal gas law, $p V=n R T$, at constant $T$ confirms that $p \propto V^{-1}$, which is according to the path shown in the right-hand corner, also including $\mathrm{A} \rightarrow \mathrm{B}$. At point $\mathrm{B}$, small drops of a liquid phase are formed. At this combination of temperature $\left(T_1\right)$ and pressure $\left(p_1\right)$, the two phases (liquid and gas) are equally stable. More liquid is gradually formed (note the drawings associated with points $C$ and $D$ ) by pushing the piston so that the volume decreases. This is done at constant pressure $\left(p_1\right)$ and constant temperature $\left(T_1\right)$. Condensation is exothermal, which means that heat has to be transferred to the surroundings in order to maintain constant temperature (cf. Chap. 1). At point $\mathrm{E}$, only liquid is present, and further compression requires a substantial increase in pressure, since a liquid is much less compressible than a gas.
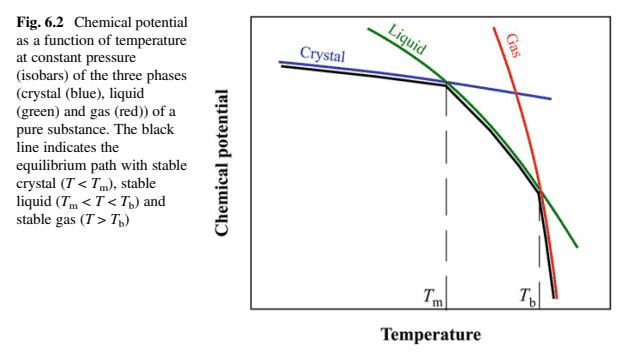
The red isotherm (marked $T_{\mathrm{c}}$ ) shows the gradual change of the gas to a liquid-like medium referred to as a supercritical fluid. The point at the maximum of the two-phase region (marked in grey) is the critical point $\left(T_{\mathrm{c}}, p_{\mathrm{c}}\right.$ and $\left.V_{\mathrm{c}}\right)$. The right-hand graph shows condensation at constant pressure. When the temperature is gradually decreased at which the two phases have equal stability is reached and by very gentle pushing of the piston, the vertical blue line is followed until all the gas has been converted to liquid. Both graphs indicate the characteristic, stepwise decrease in volume associated with the phase transition ( $\left.\Delta V_{\mathrm{tr}}\right)$. This is typical of several phase transitions, condensation, evaporation, crystallization and melting, which are referred to as first-order transitions. Let us now use the thermodynamics to derive relations between temperature and pressure for the first-order phase transitions. For a pure substance, the molar Gibbs free energy $\left(G_{\mathrm{m}}\right)$ is equal to the chemical potential $\left(\mu^\right)$ (cf. Chap. 4, Eq. (4.4) and Chap. 5, Eq. (5.10)): $$ d G_{\mathrm{m}}=-S_{\mathrm{m}} d T+V_{\mathrm{m}} d p \Leftrightarrow d \mu^=-S_{\mathrm{m}} d T+V_{\mathrm{m}} d p
$$
where $S_{\mathrm{m}}$ and $V_{\mathrm{m}}$ are respectively the molar entropy and the molar volume. The partial derivatives of the chemical potential of a pure substance with respect to $T$ and $p$ are:
$$
\begin{aligned}
&\left(\frac{\partial \mu^}{\partial T}\right)p=-S{\mathrm{m}} \
&\left(\frac{\partial \mu^}{\partial p}\right)T=V{\mathrm{m}}
\end{aligned}
$$
热力学代写
物理代写|热力学代写THERMODYNAMICS代考|CHEMICAL POTENTIAL AND PARTIAL MOLAR PROPERTIES
化学势属于偏摩尔性质,可用于评估混溶性以及对相变的影响 meltingandevaporation和溶液组成引起的浚追压。化学势的符昊是 $\mu$ 单位是焦耳每摩尔,Jmol ${ }^{-1}$ ,这表明 $\mu$ 是一个密集的财产 $i$. e. apropertythatisnotdependentonthesystemsize. 化学势可以定义为 $G$; 化学势 $\mu_{\mathrm{x}}$ 是的偏导数 $G$ 关于化合物的摩尔数 $\mathrm{x}$ ( $n_{\mathrm{x}}$ ) 在 基于化合物的解决方案中 $\mathrm{x}$ 和其他化合物,同时保持不变 $T$ 和 $p$ 以及其他化合物的摩尔数。
数字 $5.1$ 显示了两个不同的二进制系统。根据溶液的组成,将 A 分子揷入两种溶液中对局部势能有不同的影响。在原始 B 系统的情况下Fig. $5.1 a$ , A 分子仅与 B 分 子相互作用,而在另一个系统中,揷入的 $\mathrm{A}$ 分子与 $\mathrm{A}$ 分子和 $\mathrm{B}$ 分子相互作用 $F i g .5 .1 b$. 这表明 $\mathrm{A}$ 的化学势denoted $\$ \mu_{\mathrm{A}} \$$ \$是成分相关的。两种化合物的化学势 ( $\mu_{\mathrm{A}}$ 和 $\left.\mu_{\mathrm{B}}\right)$ ) 在二元解中可以定义为偏导数 $G$ 根据:
$$
\mu_{\mathrm{A}}=\left(\frac{\partial G}{\partial n_{\mathrm{A}}}\right) T, p, n \mathrm{~B} \wedge \mu_{\mathrm{B}}=\left(\frac{\partial G}{\partial n_{\mathrm{B}}}\right) T, p, n \mathrm{~A}
$$
吉布斯自由能的总微分 $(d G)$ 因此给出 $c f$. Chap. $4 ; E q .(4.4)$ 经过:
$$
d G=-S d T+V d p+\mu_{\mathrm{A}} d n_{\mathrm{A}}+\mu_{\mathrm{B}} d n_{\mathrm{B}}
$$
意思就是
$$
G=f\left(T, p, n_{\mathrm{A}}, n_{\mathrm{B}}\right)
$$
的化学势 $\mathrm{A}\left(\mu_{\mathrm{A}}\right)$ 也可以根据第 1 章从其他状态函数中定义。 4 ,方程式。 $4.1,4.2, a n d 4.3$ :
$$
\mu_{\mathrm{A}}=\left(\frac{\partial U}{\partial n_{\mathrm{A}}}\right) S, V, n \mathrm{~B} \wedge \mu_{\mathrm{A}}=\left(\frac{\partial H}{\partial n_{\mathrm{A}}}\right) S, p, n \mathrm{~B} \wedge \mu_{\mathrm{A}}=\left(\frac{\partial A}{\partial n_{\mathrm{A}}}\right) T, V, n \mathrm{~B}
$$
这表明:
$$
U=f\left(S, V, n_{\mathrm{A}}, n_{\mathrm{B}}\right) \wedge H=f\left(S, p, n_{\mathrm{A}}, n_{\mathrm{B}}\right) \wedge A=f\left(T, V, n_{\mathrm{A}}, n_{\mathrm{B}}\right)
$$
在恒定 $T$ 和常数 $p ,$ 以下表达式服从:
$$
G=n_{\mathrm{A}} \mu_{\mathrm{A}}+n_{\mathrm{B}} \mu_{\mathrm{B}}
$$
物理代写|热力学代写THERMODYNAMICS代考|ONECOMPONENT SYSTEMS: TRANSITIONS AND PHASE DIAGRAMS
本章讨论纯化合物的相和相变。相是物理上不同的物质形式,可以是纯物质,也可以是几种物质的混合物。这种相的例子是固体、液体和气体。给定物质有几种可 能的固相: 不同的晶相 polymorphism和玻璃。在混合物的情况下,液相可以以不同的组成形式共存。热力学处理平衡状态,而将要处理的相图就是从这些考虑中 获得的。相图提供了一个方便的地图,显示在哪里 $i . e$. atwhich $\$ T, p \$$ andcomposition不同的相是热力学稳定的。对于纯物质,成分不是问题。然而,形成的真 实结构可能与相图不匹配;动力学往往起决定性作用。然而,在当前文本中几乎没有涉及动力学的复杂性
从气体到液体的相变 condensation如图 6.1 所示,相图显示了不同阶段的存在 $p-V$ 空间。第三个状态函数也存在,温度 $(T)$. 中的线条 $p V$-图表示等温线。 据右上角显示的路径,还包括 $\mathrm{A} \rightarrow \mathrm{B}$. 在点 $\mathrm{B}$ ,形成小滴液相。在这种温度组合下 $\left(T_1\right)$ 和压力 $\left(p_1\right)$, 两个阶段liquidandgas同样稳定。更多的液体逐渐形成 notethedrawingsassociatedwithpoints $\$ C \$$ and $\$ D \$$ 通过推动活塞使体积减小。这是在恒定压力下完成的 $\left(p_1\right)$ 和恒温 $\left(T_1\right)$. 冷凝是放热的,这意味着必须将热 量传道到周围环境以保持恒温cf. Chap. 1. 在点 $\mathrm{E}$ ,仅存在液体,并且进一步压缩需要显着增加压力,因为液体比气体的可压缩性小得多。
红色等温线marked $\$ T_{\mathrm{c}} \$$ 显示气体逐渐变为称为超临界流体的类液体介质。两相区的最大值 markedingrey 是临界点 $\left(T_{\mathrm{c}}, p_{\mathrm{c}}\right.$ 和 $\left.V_{\mathrm{c}}\right)$. 右图显示恒压下的冷凝。当温 度逐渐降低时,达到两相具有相同稳定性的温度并通过非常轻矛的推动活塞,沿着垂直的蓝线,直到所有气体都转化为液体。两张图都表明了与相变相关的特征性
.Thisistypicalofseveralphasetransitions, condensation, evaporation, crystallizationandmelting, whicharere ferredtoas first – ordertransitions. $L$
$d G_{\mathrm{m}}=-S_{\mathrm{m}} d T+V_{\mathrm{m}} d p \Leftrightarrow d \mu=-S_{\mathrm{m}} d T+V_{\mathrm{m}} d p w h e r$ S__$^{\prime}{$ mathrm ${\mathrm{m}}}$ and $d V_{-}{\backslash \mathrm{mathrm}{\mathrm{m}}}$
arerespectivelythemolarentropyand themolarvolume. Thepartialderivativeso f thechemicalpotentialofapuresubstancewithrespecto 吨andpare:

物理代写|热力学代写Thermodynamics代考 请认准UprivateTA™. UprivateTA™为您的留学生涯保驾护航。
微观经济学代写
微观经济学是主流经济学的一个分支,研究个人和企业在做出有关稀缺资源分配的决策时的行为以及这些个人和企业之间的相互作用。my-assignmentexpert™ 为您的留学生涯保驾护航 在数学Mathematics作业代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的数学Mathematics代写服务。我们的专家在图论代写Graph Theory代写方面经验极为丰富,各种图论代写Graph Theory相关的作业也就用不着 说。
线性代数代写
线性代数是数学的一个分支,涉及线性方程,如:线性图,如:以及它们在向量空间和通过矩阵的表示。线性代数是几乎所有数学领域的核心。
博弈论代写
现代博弈论始于约翰-冯-诺伊曼(John von Neumann)提出的两人零和博弈中的混合策略均衡的观点及其证明。冯-诺依曼的原始证明使用了关于连续映射到紧凑凸集的布劳威尔定点定理,这成为博弈论和数学经济学的标准方法。在他的论文之后,1944年,他与奥斯卡-莫根斯特恩(Oskar Morgenstern)共同撰写了《游戏和经济行为理论》一书,该书考虑了几个参与者的合作游戏。这本书的第二版提供了预期效用的公理理论,使数理统计学家和经济学家能够处理不确定性下的决策。
微积分代写
微积分,最初被称为无穷小微积分或 “无穷小的微积分”,是对连续变化的数学研究,就像几何学是对形状的研究,而代数是对算术运算的概括研究一样。
它有两个主要分支,微分和积分;微分涉及瞬时变化率和曲线的斜率,而积分涉及数量的累积,以及曲线下或曲线之间的面积。这两个分支通过微积分的基本定理相互联系,它们利用了无限序列和无限级数收敛到一个明确定义的极限的基本概念 。
计量经济学代写
什么是计量经济学?
计量经济学是统计学和数学模型的定量应用,使用数据来发展理论或测试经济学中的现有假设,并根据历史数据预测未来趋势。它对现实世界的数据进行统计试验,然后将结果与被测试的理论进行比较和对比。
根据你是对测试现有理论感兴趣,还是对利用现有数据在这些观察的基础上提出新的假设感兴趣,计量经济学可以细分为两大类:理论和应用。那些经常从事这种实践的人通常被称为计量经济学家。
Matlab代写
MATLAB 是一种用于技术计算的高性能语言。它将计算、可视化和编程集成在一个易于使用的环境中,其中问题和解决方案以熟悉的数学符号表示。典型用途包括:数学和计算算法开发建模、仿真和原型制作数据分析、探索和可视化科学和工程图形应用程序开发,包括图形用户界面构建MATLAB 是一个交互式系统,其基本数据元素是一个不需要维度的数组。这使您可以解决许多技术计算问题,尤其是那些具有矩阵和向量公式的问题,而只需用 C 或 Fortran 等标量非交互式语言编写程序所需的时间的一小部分。MATLAB 名称代表矩阵实验室。MATLAB 最初的编写目的是提供对由 LINPACK 和 EISPACK 项目开发的矩阵软件的轻松访问,这两个项目共同代表了矩阵计算软件的最新技术。MATLAB 经过多年的发展,得到了许多用户的投入。在大学环境中,它是数学、工程和科学入门和高级课程的标准教学工具。在工业领域,MATLAB 是高效研究、开发和分析的首选工具。MATLAB 具有一系列称为工具箱的特定于应用程序的解决方案。对于大多数 MATLAB 用户来说非常重要,工具箱允许您学习和应用专业技术。工具箱是 MATLAB 函数(M 文件)的综合集合,可扩展 MATLAB 环境以解决特定类别的问题。可用工具箱的领域包括信号处理、控制系统、神经网络、模糊逻辑、小波、仿真等。