如果你也在 怎样代写热力学Thermodynamics PHY360这个学科遇到相关的难题,请随时右上角联系我们的24/7代写客服。热力学Thermodynamics是物理学的一个分支,涉及热、功和温度,以及它们与能量、熵以及物质和辐射的物理特性的关系。这些数量的行为受热力学四大定律的制约,这些定律使用可测量的宏观物理量来传达定量描述,但可以用统计力学的微观成分来解释。热力学适用于科学和工程中的各种主题,特别是物理化学、生物化学、化学工程和机械工程,但也适用于其他复杂领域,如气象学。
热力学Thermodynamics从历史上看,热力学的发展源于提高早期蒸汽机效率的愿望,特别是通过法国物理学家萨迪-卡诺(1824年)的工作,他认为发动机的效率是可以帮助法国赢得拿破仑战争的关键。苏格兰-爱尔兰物理学家开尔文勋爵在1854年首次提出了热力学的简明定义,其中指出:”热力学是关于热与作用在身体相邻部分之间的力的关系,以及热与电的关系的课题。” 鲁道夫-克劳修斯重述了被称为卡诺循环的卡诺原理,为热学理论提供了更真实、更健全的基础。他最重要的论文《论热的运动力》发表于1850年,首次提出了热力学的第二定律。1865年,他提出了熵的概念。1870年,他提出了适用于热的维拉尔定理。
热力学Thermodynamics代写,免费提交作业要求, 满意后付款,成绩80\%以下全额退款,安全省心无顾虑。专业硕 博写手团队,所有订单可靠准时,保证 100% 原创。最高质量的热力学Thermodynamics作业代写,服务覆盖北美、欧洲、澳洲等 国家。 在代写价格方面,考虑到同学们的经济条件,在保障代写质量的前提下,我们为客户提供最合理的价格。 由于作业种类很多,同时其中的大部分作业在字数上都没有具体要求,因此热力学Thermodynamics作业代写的价格不固定。通常在专家查看完作业要求之后会给出报价。作业难度和截止日期对价格也有很大的影响。
同学们在留学期间,都对各式各样的作业考试很是头疼,如果你无从下手,不如考虑my-assignmentexpert™!
my-assignmentexpert™提供最专业的一站式服务:Essay代写,Dissertation代写,Assignment代写,Paper代写,Proposal代写,Proposal代写,Literature Review代写,Online Course,Exam代考等等。my-assignmentexpert™专注为留学生提供Essay代写服务,拥有各个专业的博硕教师团队帮您代写,免费修改及辅导,保证成果完成的效率和质量。同时有多家检测平台帐号,包括Turnitin高级账户,检测论文不会留痕,写好后检测修改,放心可靠,经得起任何考验!
想知道您作业确定的价格吗? 免费下单以相关学科的专家能了解具体的要求之后在1-3个小时就提出价格。专家的 报价比上列的价格能便宜好几倍。
我们在物理Physical代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的物理Physical代写服务。我们的专家在电磁学Electromagnetism代写方面经验极为丰富,各种电磁学Electromagnetism相关的作业也就用不着说。
物理代写|热力学代写Thermodynamics代考|Solutions, Phase-Separated Systems
The chemical potential of a substance A in a solution can be calculated by focusing on the gas phase above the solution. At equilibrium, the chemical potential of $\mathrm{A}$ in the solution is equal to the chemical potential of $\mathrm{A}$ in the gas phase, so that the first task is to calculate the chemical potential of $\mathrm{A}$ in the gas phase.
The chemical potential $\mu$ is dependent on the pressure $(p)$ at constant temperature according to Eq. (6.2), i.e.:
$$
\left(\frac{\partial \mu}{\partial p}\right)T=V{\mathrm{m}}
$$
For a gas which obeys the ideal gas law, the following $\mu-p$ relationship is obtained:
$$
\begin{aligned}
&d \mu=V_{\mathrm{m}} d p ; V_{\mathrm{m}}=\frac{R T}{p} \Rightarrow d \mu=R T \frac{d p}{p} \
&\mu=\mu_0+R T \ln \left(\frac{p}{p_0}\right)
\end{aligned}
$$
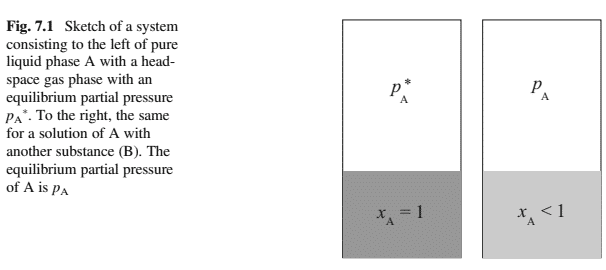
where $\mu_0$ is the chemical potential of the ideal gas at a reference pressure $\left(p_0\right)$. Figure $7.1$ shows (i) a closed system with a pure liquid $\mathrm{A}$ and a gas phase in equilibrium with the liquid phase (the pressure of component $\mathrm{A}$ is $p_{\mathrm{A}}{ }^$ ) and (ii) a similar closed system but with a binary solution with the molar composition $x_{\mathrm{A}}$. The chemical potential of the pure liquid $\mathrm{A}\left(\mu_{\mathrm{A}}{ }^\right)$ is according to Eq. (7.2) given by:
$$
\mu_{\mathrm{A}}^=\mu_{\mathrm{A}, 0}+R T \ln \left(\frac{p_{\mathrm{A}}^}{p_{\mathrm{A}, 0}}\right) \Rightarrow \mu_{\mathrm{A}, 0}=\mu_{\mathrm{A}}^-R T \ln \left(\frac{p_{\mathrm{A}}^}{p_{\mathrm{A}, 0}}\right)
$$
and the chemical potential of $\mathrm{A}$ in the solution is given by:
$$
\mu_{\mathrm{A}}=\mu_{\mathrm{A}, 0}+R T \ln \left(\frac{p_{\mathrm{A}}}{p_{\mathrm{A}, 0}}\right)
$$
The following expression is obtained by combining Eqs. (7.3) and (7.4):
$$
\mu_{\mathrm{A}}=\mu_{\mathrm{A}}^-R T \ln \left(\frac{p_{\mathrm{A}}^}{p_{\mathrm{A}, 0}}\right)+R T \ln \left(\frac{p_{\mathrm{A}}}{p_{\mathrm{A}, 0}}\right) \Rightarrow \mu_{\mathrm{A}}=\mu_{\mathrm{A}}^+R T \ln \left(\frac{p_{\mathrm{A}}}{p_{\mathrm{A}}^}\right)
$$
物理代写|热力学代写Thermodynamics代考|Chemical Equilibrium
A central part of chemical thermodynamics is concerned with chemical reactions and chemical equilibrium. This is often treated in a separate course without the strictness typical of thermodynamics. In this final chapter, we shall deal with this topic using Gibbs free energy and related state functions to describe chemical equilibrium.
Let us start with a very simple reaction: $A(g) \leftrightarrows B(g)$. The changes in the number of moles of $\mathrm{A}\left(n_{\mathrm{A}}\right)$ and $\mathrm{B}\left(n_{\mathrm{B}}\right)$ with the extent of the forward reaction, which denoted the reaction coordinate $(\xi)$, are given by:
$$
d n_{\mathrm{A}}=-d \xi ; d n_{\mathrm{B}}=d \xi
$$
The differential change in Gibbs free energy at constant $T$ and constant $p$ is given by:
$$
d G=-\mu_{\mathrm{A}} d \xi+\mu_{\mathrm{B}} d \xi=\left(\mu_{\mathrm{B}}-\mu_{\mathrm{A}}\right) d \xi
$$
which means that:
$$
\left(\frac{\partial G}{\partial \xi}\right){p, T}=\mu{\mathrm{B}}-\mu_{\mathrm{A}}
$$
This derivative, which is also a difference, is abbreviated $\Delta G_{\mathrm{r}}$ :
$$
\Delta G_{\mathrm{r}}=\left(\frac{\partial G}{\partial \xi}\right){p, T}=\mu{\mathrm{B}}-\mu_{\mathrm{A}}
$$
and, according to Chap. 7 (Eq. (7.8)), it can be expressed as:
$$
\Delta G_{\mathrm{r}}=\mu_{\mathrm{B}}-\mu_{\mathrm{A}}=\left(\mu_{\mathrm{B}}^-\mu_{\mathrm{A}}^\right)+R T \ln \left(\frac{a_{\mathrm{B}}}{a_{\mathrm{A}}}\right)
$$
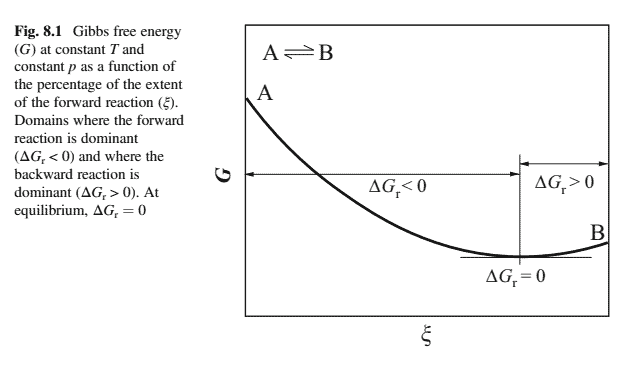
where the activity ratio, $a_{\mathrm{B}} / a_{\mathrm{A}}$, is denoted the reaction quotient $(Q)$. Figure $8.1$ shows a generic $G-\xi$ diagram. The curvature, which originates from the logarithmic term in Eq. (8.5), is the reason for the presence of a minimum point, chemical equilibrium in the $G-\xi$ diagram.
On the left-hand side of the minimum, $\Delta G_{\mathrm{r}}<0$, which indicates that the forward reaction $(\mathrm{A} \rightarrow \mathrm{B})$ dominates. This continues until the point where $\Delta G_{\mathrm{r}}=0$. If, on the other hand, the system is on the right-hand side of the minimum, $\Delta G_{\mathrm{r}}<0$ and the backward reaction ( $\mathrm{B} \rightarrow \mathrm{A}$ ) is dominant. Again, the system is striving to reach the minimum $G$-value ( $\Delta G_{\mathrm{r}}=0$ ). The condition for equilibrium can be expressed as:
$$
\Delta G_{\mathrm{r}}=0
$$
热力学代写
物理代写|热力学代写THERMODYNAMICS代考|SOLUTIONS, PHASE-SEPARATED SYSTEMS
溶液中物质 $\mathrm{A}$ 的化学势可以通过关注溶液上方的气相来计算。在平衡时,化学势 $\mathrm{A}$ 溶液中的化学势等于 $\mathrm{A}$ 在气相中,因此首要任务是计算化学势 $\mathrm{A}$ 在气相。
化学势 $\mu$ 取决于压力 $(p)$ 根据方程式在恒温下。6.2, IE:
$$
\left(\frac{\partial \mu}{\partial p}\right) T=V \mathrm{~m}
$$
对于符合理想气体定律的气体,有以下 $\mu-p$ 得到关系:
$$
d \mu=V_{\mathrm{m}} d p ; V_{\mathrm{m}}=\frac{R T}{p} \Rightarrow d \mu=R T \frac{d p}{p} \quad \mu=\mu_0+R T \ln \left(\frac{p}{p_0}\right)
$$
在哪里 $\mu_0$ 是理想气体在参考压力下的化学势 $\left(p_0\right)$. 数字 $7.1$ 节目 $i$ 具有纯液体的封闭系统 $\mathrm{A}$ 和与液相平衡的气相 thepressureofcomponent $\$ \mathrm{~A} \$ i s \$ p_{\mathrm{A}}{ }^{\$}$ 和 $i$ 搂类似
和化学势 $\mathrm{A}$ 在解决方䯃中由下式给出:
$$
\mu_{\mathrm{A}}=\mu_{\mathrm{A}, 0}+R T \ln \left(\frac{p_{\mathrm{A}}}{p_{\mathrm{A}, 0}}\right)
$$
物理代写|热力学代写THERMODYNAMICS代考|CHEMICAL EQUILIBRIUM
化学热力学的核心部分涉及化学反应和化学平衡。这通常在单独的课程中处理,没有热力学典型的严格性。在最后一章中,我们将使用吉布斯自由能和相关的状态 函数来描述化学平衡来处理这个主题。
让我们从一个非常简单的反应开始: $A(g) \leftrightarrows B(g)$. 摩尔数的变化 $\mathrm{A}\left(n_{\mathrm{A}}\right)$ 和 $\mathrm{B}\left(n_{\mathrm{B}}\right)$ 正反应的程度,表示反应坐标 $(\xi)$,由下式给出:
$$
d n_{\mathrm{A}}=-d \xi ; d n_{\mathrm{B}}=d \xi
$$
常数吉布斯目由能的微分变化T和常数 $p$ 是 (谁) 给的:
$$
d G=-\mu_{\mathrm{A}} d \xi+\mu_{\mathrm{B}} d \xi=\left(\mu_{\mathrm{B}}-\mu_{\mathrm{A}}\right) d \xi
$$
意思就是:
$$
\left(\frac{\partial G}{\partial \xi}\right) p, T=\mu \mathrm{B}-\mu_{\mathrm{A}}
$$
这个导数,也是有区别的,简写 $\Delta G_{\mathrm{r}}$ :
$$
\Delta G_{\mathrm{r}}=\left(\frac{\partial G}{\partial \xi}\right) p, T=\mu \mathrm{B}-\mu_{\mathrm{A}}
$$
并且,根据章。 $7 E q \cdot(7.8)$ ,可以人表示为:
其中活动比率, $a_{\mathrm{B}} / a_{\mathrm{A}}$, 表示反应商 $(Q)$. 数字 $8.1$ 显示一个通用的 $G-\xi$ 图表。曲率源自方程式中的对数项。8.5,是存在最小点的原因,化学平衡在 $G-\xi$ 图表。
在最小值的左侧, $\Delta G_{\mathrm{r}}<0$, 这表明正向反应 $(\mathrm{A} \rightarrow \mathrm{B})$ 占主导地位。这种情况一直持续到 $\Delta G_{\mathrm{r}}=0$. 另一方面,如果系统在最小值的右侧, $\Delta G_{\mathrm{r}}<0$ 和逆向反应 $\$ \mathrm{~B} \rightarrow \mathrm{A} \$$ 占主导地位。同样,该乎统正在努力达到最低限度 $G$-价值 $\$ \Delta G_{\mathrm{r}}=0 \$$. 平衡条件可以表示为:
$$
\Delta G_{\mathrm{r}}=0
$$

物理代写|热力学代写Thermodynamics代考 请认准UprivateTA™. UprivateTA™为您的留学生涯保驾护航。
微观经济学代写
微观经济学是主流经济学的一个分支,研究个人和企业在做出有关稀缺资源分配的决策时的行为以及这些个人和企业之间的相互作用。my-assignmentexpert™ 为您的留学生涯保驾护航 在数学Mathematics作业代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的数学Mathematics代写服务。我们的专家在图论代写Graph Theory代写方面经验极为丰富,各种图论代写Graph Theory相关的作业也就用不着 说。
线性代数代写
线性代数是数学的一个分支,涉及线性方程,如:线性图,如:以及它们在向量空间和通过矩阵的表示。线性代数是几乎所有数学领域的核心。
博弈论代写
现代博弈论始于约翰-冯-诺伊曼(John von Neumann)提出的两人零和博弈中的混合策略均衡的观点及其证明。冯-诺依曼的原始证明使用了关于连续映射到紧凑凸集的布劳威尔定点定理,这成为博弈论和数学经济学的标准方法。在他的论文之后,1944年,他与奥斯卡-莫根斯特恩(Oskar Morgenstern)共同撰写了《游戏和经济行为理论》一书,该书考虑了几个参与者的合作游戏。这本书的第二版提供了预期效用的公理理论,使数理统计学家和经济学家能够处理不确定性下的决策。
微积分代写
微积分,最初被称为无穷小微积分或 “无穷小的微积分”,是对连续变化的数学研究,就像几何学是对形状的研究,而代数是对算术运算的概括研究一样。
它有两个主要分支,微分和积分;微分涉及瞬时变化率和曲线的斜率,而积分涉及数量的累积,以及曲线下或曲线之间的面积。这两个分支通过微积分的基本定理相互联系,它们利用了无限序列和无限级数收敛到一个明确定义的极限的基本概念 。
计量经济学代写
什么是计量经济学?
计量经济学是统计学和数学模型的定量应用,使用数据来发展理论或测试经济学中的现有假设,并根据历史数据预测未来趋势。它对现实世界的数据进行统计试验,然后将结果与被测试的理论进行比较和对比。
根据你是对测试现有理论感兴趣,还是对利用现有数据在这些观察的基础上提出新的假设感兴趣,计量经济学可以细分为两大类:理论和应用。那些经常从事这种实践的人通常被称为计量经济学家。
Matlab代写
MATLAB 是一种用于技术计算的高性能语言。它将计算、可视化和编程集成在一个易于使用的环境中,其中问题和解决方案以熟悉的数学符号表示。典型用途包括:数学和计算算法开发建模、仿真和原型制作数据分析、探索和可视化科学和工程图形应用程序开发,包括图形用户界面构建MATLAB 是一个交互式系统,其基本数据元素是一个不需要维度的数组。这使您可以解决许多技术计算问题,尤其是那些具有矩阵和向量公式的问题,而只需用 C 或 Fortran 等标量非交互式语言编写程序所需的时间的一小部分。MATLAB 名称代表矩阵实验室。MATLAB 最初的编写目的是提供对由 LINPACK 和 EISPACK 项目开发的矩阵软件的轻松访问,这两个项目共同代表了矩阵计算软件的最新技术。MATLAB 经过多年的发展,得到了许多用户的投入。在大学环境中,它是数学、工程和科学入门和高级课程的标准教学工具。在工业领域,MATLAB 是高效研究、开发和分析的首选工具。MATLAB 具有一系列称为工具箱的特定于应用程序的解决方案。对于大多数 MATLAB 用户来说非常重要,工具箱允许您学习和应用专业技术。工具箱是 MATLAB 函数(M 文件)的综合集合,可扩展 MATLAB 环境以解决特定类别的问题。可用工具箱的领域包括信号处理、控制系统、神经网络、模糊逻辑、小波、仿真等。