如果你也在 怎样代写无机化学Inorganic Chemistry CHEM433这个学科遇到相关的难题,请随时右上角联系我们的24/7代写客服。无机化学Inorganic Chemistry关注的是无机化合物的属性和行为,其中包括金属、矿物和有机金属化合物。
无机化学Inorganic Chemistry涉及到无机和有机金属化合物的合成和行为。这个领域涵盖了非碳基的化合物,这些化合物是有机化学的主题。这两门学科之间的区别远非绝对,因为有机金属化学的分支学科有很多重叠。它在化学工业的各个方面都有应用,包括催化、材料科学、颜料、表面活性剂、涂料、药物、燃料和农业。
my-assignmentexpert™无机化学Inorganic Chemistry代写,免费提交作业要求, 满意后付款,成绩80\%以下全额退款,安全省心无顾虑。专业硕 博写手团队,所有订单可靠准时,保证 100% 原创。my-assignmentexpert™, 最高质量的无机化学Inorganic Chemistry作业代写,服务覆盖北美、欧洲、澳洲等 国家。 在代写价格方面,考虑到同学们的经济条件,在保障代写质量的前提下,我们为客户提供最合理的价格。 由于统计Statistics作业种类很多,同时其中的大部分作业在字数上都没有具体要求,因此无机化学Inorganic Chemistry作业代写的价格不固定。通常在经济学专家查看完作业要求之后会给出报价。作业难度和截止日期对价格也有很大的影响。
想知道您作业确定的价格吗? 免费下单以相关学科的专家能了解具体的要求之后在1-3个小时就提出价格。专家的 报价比上列的价格能便宜好几倍。
my-assignmentexpert™ 为您的留学生涯保驾护航 在作业代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的作业代写服务。我们的专家在无机化学Inorganic Chemistry代写方面经验极为丰富,各种无机化学Inorganic Chemistry相关的作业也就用不着 说。
我们提供的无机化学Inorganic Chemistry CHEM433及其相关学科的代写,服务范围广, 其中包括但不限于:
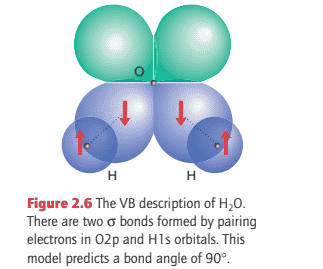
化学代写|无机化学代写Inorganic Chemistry代写|Polyatomic molecules
Key points: Each $\sigma$ bond in a polyatomic molecule is formed by the spin pairing of electrons in any neighbouring atomic orbitals with cylindrical symmetry about the relevant internuclear axis; $\pi$ bonds are formed by pairing electrons that occupy neighbouring atomic orbitals of the appropriate symmetry.
To introduce polyatomic molecules we consider the $\mathrm{VB}$ description of $\mathrm{H}{2} \mathrm{O}$. The valence electron configuration of a hydrogen atom is $1 \mathrm{~s}^{1}$ and that of an $\mathrm{O}$ atom is $2 \mathrm{~s}^{2} 2 \mathrm{p}{z}^{2} 2 \mathrm{p}{y}^{1} 2 \mathrm{p}{x}^{1}$. The two unpaired electrons in the $\mathrm{O} 2 \mathrm{p}$ orbitals can each pair with an electron in an H1s orbital, and each combination results in the formation of a $\sigma$ bond (each bond has cylindrical symmetry about the respective $\mathrm{O}-\mathrm{H}$ internuclear axis). Because the $2 \mathrm{p}{y}$ and $2 \mathrm{p}{x}$ orbitals lie at $90^{\circ}$ to each other, the two $\sigma$ bonds also lie at $90^{\circ}$ to each other (Fig. 2.6). We can predict, therefore, that $\mathrm{H}{2} \mathrm{O}$ should be an angular molecule, which it is. However, the theory predicts a bond angle of $90^{\circ}$ whereas the actual bond angle is $104.5^{\circ}$. Similarly, to predict the structure of an ammonia molecule, $\mathrm{NH}{3}$, we start by noting that the valence electron configuration of an $\mathrm{N}$ atom given previously suggests that three $\mathrm{H}$ atoms can form bonds by spin pairing with the electrons in the three half-filled $2 \mathrm{p}$ orbitals. The latter are perpendicular to each other, so we predict a trigonal-pyramidal molecule with a bond angle of $90^{\circ}$. An $\mathrm{NH}_{3}$ molecule is indeed trigonal pyramidal, but the experimental bond angle is $107^{\circ}$.
Another deficiency of the VB theory presented so far is its inability to account for the tetravalence of carbon-its familiar ability to form four bonds as exemplified in methane, $\mathrm{CH}{4}$, which is tetrahedral, like $\mathrm{PCl}{4}^{+}(\mathbf{1 1})$ The ground-state configuration of $\mathrm{C}$ is $2 s^{2} 2 p_{z}^{1} 2 p_{y}^{1}$, which suggests that a $\mathrm{C}$ atom should be capable of forming only two bonds, not four. Clearly, something is missing from the VB approach.
These two deficiencies-the failure to account for bond angles and the valence of carbon-are overcome by introducing two new features, promotion and hybridization.
化学代写|无机化学代写Inorganic Chemistry代写|Hypervalence
Promotion is the excitation of an electron to an orbital of higher energy in the course of bond formation. Although electron promotion requires an investment of energy, that investment is worthwhile if the energy can be more than recovered from the greater strength or number of bonds that it allows to be formed. Promotion is not a ‘real’ process in which an atom somehow becomes excited and then forms bonds: it is a contribution to the overall energy change that occurs when bonds form.
In carbon, for example, the promotion of a 2 s electron to a $2 \mathrm{p}$ orbital can be thought of as leading to the configuration $2 s^{1} 2 p_{z}^{1} 2 p_{y}^{1} 2 p_{x}^{1}$, with four unpaired electrons in separate orbitals. These electrons may pair with four electrons in orbitals provided by four other atoms, such as four H1s orbitals if the molecule is $\mathrm{CH}_{4}$, and hence form four $\sigma$ bonds. Although energy was required to promote the electron, it is more than recovered by the atom’s ability to form four bonds in place of the two bonds of the unpromoted atom. Promotion, and the formation of four bonds, is a characteristic feature of carbon and of its congeners in Group 14 (Chapter 14) because the promotion energy is quite small: the promoted electron leaves a doubly occupied $n \mathrm{~s}$ orbital and enters a vacant $n \mathrm{p}$ orbital, hence significantly relieving the electron-electron repulsion it experiences in the ground state. This promotion of an electron becomes energetically less favourable as the group is descended, and divalent compounds are common for tin and lead (Section 9.5).
无机化学代写
化学代写|无机化学代写INORGANIC CHEMISTRY代 写|POLYATOMIC MOLECULES
关键点:每个 $\sigma$ 厎原子分子中的键是由任何相邻原子轨道中的电子自旋配对形成的,该原子轨道具有关于相关核间轴的圆柱对称性; $\pi$ 键是通过将占据具有适当对称性 的相邻原子轨道的电子配对形成的。
为了引入多原子分子,我们考虑VB描述 $\mathrm{H} 2 \mathrm{O}$. 氢原子的价电子构型为 $1 \mathrm{~s}^{1}$ 和一个O原子是 $2 \mathrm{~s}^{2} 2 \mathrm{p} z^{2} 2 \mathrm{p} y^{1} 2 \mathrm{p} x^{1}$. 中的两个不成对电子 $2 \mathrm{p}$ 每个轨道都可以与与 $\mathrm{H} 1 \mathrm{~s}$ 轨道中 的一个电子配对,并且每个组合都会形成一个 $\sigma$ 纽带eachbondhascylindricalsymmetryabouttherespective\$O – H\$internuclearaxis. 因为 $2 \mathrm{p} y$ 和 $2 \mathrm{p} x$ 轨道位于 $90^{\circ}$ 对彼此,两人 $\sigma$ 债券也位于 $90^{\circ}$ 对彼此Fig. 2.6. 因此,我们可以预测,H2O应该是一个角分子,它就是。然而,该理论预测键角为 $90^{\circ}$ 而实际的键角是 $104.5^{\circ}$. 类似 地,为了预测氨分子的结构,NH3,我们首先注意到一个的价电子构型N先前给出的原子表明三个H原子可以通过与三个半填充中的电子自旋配对形成䋖 2 p轨道。后 者相互垂直,因此我们预测一个三角㔼分子,其键角为 $90^{\circ}$.一个 $\mathrm{NH}{3}$ 分子确实是三角㔼体,但实验旔角是 $107^{\circ}$. 迄今为止提出的 VB 理论的另一个缺陷是它无法解释碳的四价-它熟悉的形成四个键的能力,例如甲烷, $\mathrm{CH} 4$ ,这是四面体,如 $\mathrm{PCl4}{ }^{+}(11)$ 的基态配置 $\mathrm{C}$ 是 $2 s^{2} 2 p{z}^{1} 2 p_{y}^{1}$ ,这表明一个C原子应该只能形成两个键,而不是四个。显然,VB方法缺少某些东西。
这两个缺陷一一末能考虑键角和碳的化合价一一通过引入两个新特征,促进和杂化来克服。
化学代写|无机化学代写INORGANIC CHEMISTRY代 写|HYPERVALENCE
促进不是一个原子以某种方式被邀发然后形成犍的 “真实”过程: 它是对键形成时发生的整体能量变化的贡献。
例如,在碳中,将 $2 \mathrm{~s}$ 电子提升为 $2 \mathrm{p}$ 轨道可以被认为是导致配置 $2 s^{1} 2 p_{z}^{1} 2 p_{y}^{1} 2 p_{x}^{1}$ ,在不同的轨道上有四个不成对的电子。这些电子可能与四个其他原子提供的轨道中的 四个电子配对,例如如果分子是四个 $\mathrm{H} 1 \mathrm{~s}$ 轨道 $\mathrm{CH}_{4}$ ,因此形成四 $\sigma$ 债券。尽管促进电子需要能量,但原子能够形成四个键来代莫末被促进的原子的两个键,从而恢复了 能量。促进和四个键的形成是第 14 组中碳及其同系物的特征Chapter 14 因为促进能量很小: 被促进的电子留下双重占据 $n$ 进入一个空的轨道 $n \mathrm{p}$ 轨道,因此显着减轻 了它在基态中经历的电子-电子排斥。随着基团的下降,电子的这种促进在能量上变得不太有利,并且二价化合物对于锡和铅很常见Section9.5.

化学代写|无机化学代写Inorganic Chemistry代写 请认准UprivateTA™. UprivateTA™为您的留学生涯保驾护航。
微观经济学代写
微观经济学是主流经济学的一个分支,研究个人和企业在做出有关稀缺资源分配的决策时的行为以及这些个人和企业之间的相互作用。my-assignmentexpert™ 为您的留学生涯保驾护航 在数学Mathematics作业代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的数学Mathematics代写服务。我们的专家在图论代写Graph Theory代写方面经验极为丰富,各种图论代写Graph Theory相关的作业也就用不着 说。
线性代数代写
线性代数是数学的一个分支,涉及线性方程,如:线性图,如:以及它们在向量空间和通过矩阵的表示。线性代数是几乎所有数学领域的核心。
博弈论代写
现代博弈论始于约翰-冯-诺伊曼(John von Neumann)提出的两人零和博弈中的混合策略均衡的观点及其证明。冯-诺依曼的原始证明使用了关于连续映射到紧凑凸集的布劳威尔定点定理,这成为博弈论和数学经济学的标准方法。在他的论文之后,1944年,他与奥斯卡-莫根斯特恩(Oskar Morgenstern)共同撰写了《游戏和经济行为理论》一书,该书考虑了几个参与者的合作游戏。这本书的第二版提供了预期效用的公理理论,使数理统计学家和经济学家能够处理不确定性下的决策。
微积分代写
微积分,最初被称为无穷小微积分或 “无穷小的微积分”,是对连续变化的数学研究,就像几何学是对形状的研究,而代数是对算术运算的概括研究一样。
它有两个主要分支,微分和积分;微分涉及瞬时变化率和曲线的斜率,而积分涉及数量的累积,以及曲线下或曲线之间的面积。这两个分支通过微积分的基本定理相互联系,它们利用了无限序列和无限级数收敛到一个明确定义的极限的基本概念 。
计量经济学代写
什么是计量经济学?
计量经济学是统计学和数学模型的定量应用,使用数据来发展理论或测试经济学中的现有假设,并根据历史数据预测未来趋势。它对现实世界的数据进行统计试验,然后将结果与被测试的理论进行比较和对比。
根据你是对测试现有理论感兴趣,还是对利用现有数据在这些观察的基础上提出新的假设感兴趣,计量经济学可以细分为两大类:理论和应用。那些经常从事这种实践的人通常被称为计量经济学家。
Matlab代写
MATLAB 是一种用于技术计算的高性能语言。它将计算、可视化和编程集成在一个易于使用的环境中,其中问题和解决方案以熟悉的数学符号表示。典型用途包括:数学和计算算法开发建模、仿真和原型制作数据分析、探索和可视化科学和工程图形应用程序开发,包括图形用户界面构建MATLAB 是一个交互式系统,其基本数据元素是一个不需要维度的数组。这使您可以解决许多技术计算问题,尤其是那些具有矩阵和向量公式的问题,而只需用 C 或 Fortran 等标量非交互式语言编写程序所需的时间的一小部分。MATLAB 名称代表矩阵实验室。MATLAB 最初的编写目的是提供对由 LINPACK 和 EISPACK 项目开发的矩阵软件的轻松访问,这两个项目共同代表了矩阵计算软件的最新技术。MATLAB 经过多年的发展,得到了许多用户的投入。在大学环境中,它是数学、工程和科学入门和高级课程的标准教学工具。在工业领域,MATLAB 是高效研究、开发和分析的首选工具。MATLAB 具有一系列称为工具箱的特定于应用程序的解决方案。对于大多数 MATLAB 用户来说非常重要,工具箱允许您学习和应用专业技术。工具箱是 MATLAB 函数(M 文件)的综合集合,可扩展 MATLAB 环境以解决特定类别的问题。可用工具箱的领域包括信号处理、控制系统、神经网络、模糊逻辑、小波、仿真等。

