如果你也在 怎样代写有机化学organic chemistry这个学科遇到相关的难题,请随时右上角联系我们的24/7代写客服。有机化学organic chemistry是化学的一个分支,研究含有碳-碳共价键的有机化合物的结构、性质和反应。对性质的研究包括物理和化学性质,以及对化学反应性的评估,以了解其行为。有机反应的研究包括天然产品、药物和聚合物的化学合成,以及在实验室和通过理论(in silico)研究单个有机分子。
有机化学organic chemistry研究的化学品范围包括碳氢化合物(只含碳和氢的化合物)以及以碳为基础但也含有其他元素的化合物,特别是氧、氮、硫、磷(包括在许多生化制品中)和卤素。有机金属化学是研究含有碳-金属键的化合物。此外,当代研究的重点是涉及其他有机金属的有机化学,包括镧系元素,但特别是过渡金属锌、铜、钯、镍、钴、钛和铬。
my-assignmentexpert™ 有机化学organic chemistry作业代写,免费提交作业要求, 满意后付款,成绩80\%以下全额退款,安全省心无顾虑。专业硕 博写手团队,所有订单可靠准时,保证 100% 原创。my-assignmentexpert™, 最高质量的有机化学organic chemistry作业代写,服务覆盖北美、欧洲、澳洲等 国家。 在代写价格方面,考虑到同学们的经济条件,在保障代写质量的前提下,我们为客户提供最合理的价格。 由于统计Statistics作业种类很多,同时其中的大部分作业在字数上都没有具体要求,因此有机化学organic chemistry作业代写的价格不固定。通常在经济学专家查看完作业要求之后会给出报价。作业难度和截止日期对价格也有很大的影响。
想知道您作业确定的价格吗? 免费下单以相关学科的专家能了解具体的要求之后在1-3个小时就提出价格。专家的 报价比上列的价格能便宜好几倍。
my-assignmentexpert™ 为您的留学生涯保驾护航 在化学Chemical作业代写方面已经树立了自己的口碑, 保证靠谱, 高质且原创的化学Chemical代写服务。我们的专家在有机化学organic chemistry代写方面经验极为丰富,各种有机化学organic chemistry相关的作业也就用不着 说。
我们提供的有机化学organic chemistry及其相关学科的代写,服务范围广, 其中包括但不限于:
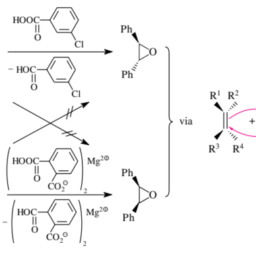
化学代写|有机化学代写organic chemistry代考|A Cycloaddition Forming Three-Membered Rings
When all these results are analyzed accurately, it is seen that addition reactions to the $\mathrm{C}=\mathrm{X}$ double bond
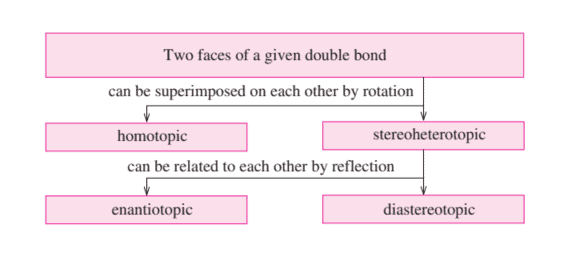
- of achiral compounds (i.e., to $\mathrm{C}=\mathrm{X}$ double bonds with homotopic or enantiotopic faces) cannot take place enantioselectively; they always give racemic mixtures (e.g., hydroboration in Figure 3.19);
- of chiral compounds (i.e., to $\mathrm{C}=\mathrm{X}$ double bonds with diastereotopic faces) can take place diastereoselectively with achiral reagents. In this case we have substrate control of stereoselectivity (e.g., hydroborations in Figures $3.20$ and 3.21); or
- of achiral compounds (i.e., to $\mathrm{C}=\mathrm{X}$ double bonds with homotopic or enantiotopic faces) with chiral reagents can lead to enantiomerically enriched or enantiomerically pure compounds.
An enantioselective addition of the latter type (here) or, in general, the successful conversion of achiral starting materials into enantiomerically enriched or enantiomerically pure products is referred to as asymmetric synthesis (for examples, see Sections 3.4.2, 3.4.6, 8.4, 8.5.2, 14.4.7).
化学代写|有机化学代写organic chemistry代考|Asymmetric Hydroboration of Achiral Olefins
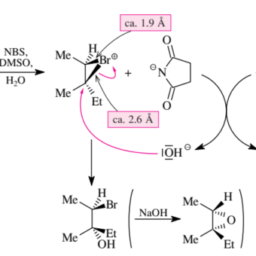
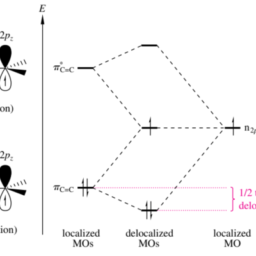
The conclusion drawn from Section 3.4.1 for the hydroborations to be discussed here is this: an addition reaction of an enantiomerically pure chiral reagent to a $\mathrm{C}=\mathrm{X}$ double bond with enantiotopic faces can take place via two transition states that are diastereomorphic and thus generally differing from one another in energy. In agreement with this statement, there are diastereoselective additions of enantiomerically pure mono- or dialkylboranes to $\mathrm{C}=\mathrm{C}$ double bonds that possess enantiotopic faces. Consequently, when one subsequently oxidizes all $\mathrm{C}-\mathrm{B}$ bonds to $\mathrm{C}-\mathrm{OH}$ bonds, one has realized an enantioselective hydration of the respective olefin.
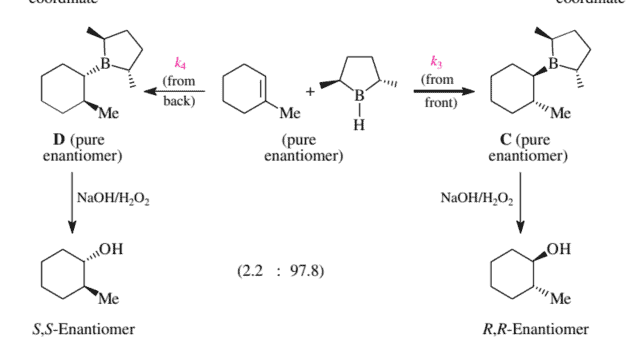
An especially efficient reagent of this type is the boron-containing five-membered ring compound shown in Figure 3.24. Since this reagent is quite difficult to synthesize, it has not been used much in asymmetric synthesis. Nonetheless, this reagent will be presented here simply because it is particularly easy to see which face of a $\mathrm{C}=\mathrm{C}$ double bond it will attack.
In the structure shown in Figure $3.24$ the top side attack of this borane on the $\mathrm{C}=\mathrm{C}$ double bond of 1-methylcyclohexene prevails kinetically over the bottom side attack. This is because only the top side attack of the boranes avoids steric interactions between the methyl substituents on the borane and the six-membered ring. In other words, the reagent determines the face to which it adds. We thus have reagent control of stereoselectivity. As a result, the mixture of the diastereomeric trialkylboranes $\mathbf{C}$ and $\mathbf{D}$, both of which are pure enantiomers, is produced with $d s=97.8: 2.2$. After the normal $\mathrm{NaOH} / \mathrm{H}{2} \mathrm{O}{2}$ treatment, they give a $97.8: 2.2$ mixture of the enantiomeric trans-2-methylcyclohexanols. The $1 R, 2 R$ alcohol will therefore have an $e e$ value of $97.8 \%-$ $2.2 \%=95.6 \%$.
The $S, S$ enantiomer of this alcohol is obtained with the same $e e$ value of $95.6 \%$ when the enantiomer of the borane shown in Figure $3.24$ is used for the hydroboration of 1methylcyclohexene. The first problem we ran into in the introduction to Section $3.4$ is thereby solved!
化学代写|有机化学代写ORGANIC CHEMISTRY代考|Thought Experiment I on the Hydroboration of Chiral Olefins with Chiral Boranes: Mutual Kinetic Resolution
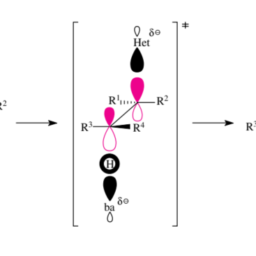
During the addition of a racemic chiral dialkylborane to a racemic chiral olefin a maximum of four diastereomeric racemic trialkylboranes can be produced. Figure $3.25$ il-lustrates this using the example of the hydroboration of 3 -ethyl-1-methylcyclohexene with the cyclic borane from Figure $3.24$. This hydroboration, however, was never carried out experimentally. This should not prevent us from considering what would happen if it were carried out.
Our earlier statements on substrate and reagent control of stereoselectivity during hydroborations are incorporated in Figure 3.25. Because of the obvious analogies between the old and the new reactions, the following can be predicted about the product distribution shown:
- As the main product we expect the racemic trialkylborane $\mathbf{E}$; the substrate and the reagent controls work together to promote its formation.
- The racemic trialkylborane $\mathbf{H}$ should be produced in trace quantities only. Its formation is disfavored by both the reagent and the substrate control.
- As minor products we expect the racemic trialkylboranes $\mathbf{F}$ and/or $\mathbf{G} ; \mathbf{F}$ is favored by reagent and disfavored by substrate control of stereoselectivity, whereas for $\mathbf{G}$ it is exactly the opposite.
We thus summarize: the yield ratios of the conceivable hydroboration products $\mathbf{E}$, $\mathbf{F}, \mathbf{G}$, and H should be much:little:little:none. One enantiomer of E comes from the reaction of the $S$-olefin with the $S, S$-borane; the other enantiomer of $\mathbf{E}$ comes from the reaction of the $R$-olefin with the $R, R$-borane. Thus each enantiomer of the reagent has preferentially reacted with one enantiomer of the substrate. The diastereoselectivity of this reaction thus corresponds to a mutual kinetic resolution.
The condition for the occurrence of a mutual kinetic resolution is thus that considerable substrate control of stereoselectivity and considerable reagent control of stereoselectivity occur simultaneously.
From the diastereoselectivities in Figure $3.25$ one concludes the following for the rate constants: $k_{5}>k_{6}, k_{7}>k_{8}$ (which implies $k_{5} \gg k_{8}$ ). It is not known whether $k_{6}$ or $k_{7}$ is greater.
For the discussion in Sections $3.4 .4$ and $3.4 .5$, we will assume(!) that $k_{6}>k_{7}$; that is, the reagent control of stereoselectivity is more effective than the substrate control of stereoselectivity. The justification for this assumption is simply that it makes additional thought experiments possible. These are useful for explaining interesting phenomena associated with stereoselective synthesis, which are known from other reactions. Because the thought experiments are much easier to understand than many of the actual experiments, their presentation is given preference.
有机化学代写
化学代写|有机化学代写ORGANIC CHEMISTRY代考|A CYCLOADDITION FORMING THREE-MEMBERED RINGS
当对所有这些结果进行准确分析时,可以看出加成反应C=X双键
- of achiral compounds (i.e., to $\mathrm{C}=\mathrm{X}$ double bonds with homotopic or enantiotopic faces) cannot take place enantioselectively; they always give racemic mixtures (e.g., hydroboration in Figure 3.19);
- of chiral compounds (i.e., to $\mathrm{C}=\mathrm{X}$ double bonds with diastereotopic faces) can take place diastereoselectively with achiral reagents. In this case we have substrate control of stereoselectivity (e.g., hydroborations in Figures $3.20$ and 3.21); or
- of achiral compounds (i.e., to $\mathrm{C}=\mathrm{X}$ double bonds with homotopic or enantiotopic faces) with chiral reagents can lead to enantiomerically enriched or enantiomerically pure compounds.
后一种类型的对映选择性加成H和r和或者,一般而言,将非手性原料成功转化为对映体富集或对映体纯的产品称为不对称合成F这r和X一种米pl和s,s和和小号和C吨一世这ns3.4.2,3.4.6,8.4,8.5.2,14.4.7.
化学代写|有机化学代写ORGANIC CHEMISTRY代考|ASYMMETRIC HYDROBORATION OF ACHIRAL OLEFINS
从第 3.4.1 节得出的关于此处讨论的硼氢化的结论是:对映体纯手性试剂与C=X与对映体面的双键可以通过两个非对映体的过渡态发生,因此通常在能量上彼此不同。与该陈述一致,对映体纯的单烷基或二烷基硼烷存在非对映选择性添加到C=C具有对映体面的双键。因此,当一个人随后氧化所有C−乙债券C−这H键,人们已经实现了各自烯烃的对映选择性水合。
这种类型的一种特别有效的试剂是图 3.24 中所示的含硼五元环化合物。由于这种试剂很难合成,因此它在不对称合成中的应用不多。尽管如此,这里将介绍该试剂只是因为它特别容易看出C=C双键它会攻击。
在如图所示的结构中3.24这种硼烷的顶部攻击C=C1-甲基环己烯的双键在动力学上优于底侧攻击。这是因为只有硼烷的顶侧攻击避免了硼烷上的甲基取代基与六元环之间的空间相互作用。换句话说,试剂决定了它添加的面。因此,我们有立体选择性的试剂控制。结果,非对映体三烷基硼烷的混合物C和D,它们都是纯对映异构体,用ds=97.8:2.2. 正常后$\mathrm{NaOH}/\mathrm{H} {2}\mathrm{O} {2吨r和一种吨米和n吨,吨H和是G一世在和一种97.8: 2.2米一世X吨在r和这F吨H和和n一种n吨一世这米和r一世C吨r一种ns−2−米和吨H是lC是Cl这H和X一种n这ls.吨H和1 右,2 右一种lC这H这l在一世ll吨H和r和F这r和H一种在和一种n并且和在一种l在和这F97.8 \%-2.2 \%=95.6 \%$.
这小号,小号这种醇的对映异构体是用相同的方法获得的和和的价值95.6%当硼烷的对映异构体如图3.24用于1甲基环己烯的硼氢化。我们在章节介绍中遇到的第一个问题3.4从而解决!
化学代写|有机化学代写ORGANIC CHEMISTRY代考|THOUGHT EXPERIMENT I ON THE HYDROBORATION OF CHIRAL OLEFINS WITH CHIRAL BORANES: MUTUAL KINETIC RESOLUTION
在将外消旋手性二烷基硼烷添加到外消旋手性烯烃中的过程中,最多可以产生四种非对映异构的外消旋三烷基硼烷。数字3.25使用来自图 3-乙基-1-甲基环己烯与环状硼烷的硼氢化的例子来说明这一点3.24. 然而,这种硼氢化从未进行过实验。这不应阻止我们考虑如果执行会发生什么。
我们之前关于硼氢化过程中立体选择性的底物和试剂控制的陈述已纳入图 3.25。由于新旧反应之间存在明显的相似性,因此可以预测如下所示的产物分布:
- 作为主要产品,我们期望外消旋三烷基硼烷和; 底物和试剂对照共同作用以促进其形成。
- 外消旋三烷基硼烷H应仅以微量生产。试剂和底物对照都不利于其形成。
- 作为次要产品,我们预计外消旋三烷基硼烷F和/或G;F受试剂的青睐而不受立体选择性的底物控制的影响,而对于G恰恰相反。
因此,我们总结: 可想象的硼氢化产物的产率和, F,G, H 应该是 much:little:little:none。E的一种对映异构体来自小号-烯烃与小号,小号-硼烷;的另一种对映体和来自于反应R-烯烃与R,R-硼烷。因此,试剂的每种对映异构体优先与底物的一种对映异构体反应。因此,该反应的非对映选择性对应于相互动力学拆分。
因此,发生相互动力学拆分的条件是立体选择性的相当大的底物控制和立体选择性的相当大的试剂控制同时发生。
从图中的非对映选择性3.25对速率常数得出以下结论:ķ5>ķ6,ķ7>ķ8 在H一世CH一世米pl一世和s$ķ5≫ķ8$. 不知是否ķ6或者ķ7更伟大。
用于章节中的讨论3.4.4和3.4.5, 我们假设!那ķ6>ķ7; 即立体选择性的试剂控制比立体选择性的底物控制更有效。这个假设的理由很简单,它使额外的思想实验成为可能。这些对于解释与立体选择性合成相关的有趣现象很有用,这些现象在其他反应中是已知的。因为思想实验比许多实际实验更容易理解,所以优先考虑它们的演示。

化学代写|有机化学代写organic chemistry代考 请认准UprivateTA™. UprivateTA™为您的留学生涯保驾护航。
电磁学代考
物理代考服务:
物理Physics考试代考、留学生物理online exam代考、电磁学代考、热力学代考、相对论代考、电动力学代考、电磁学代考、分析力学代考、澳洲物理代考、北美物理考试代考、美国留学生物理final exam代考、加拿大物理midterm代考、澳洲物理online exam代考、英国物理online quiz代考等。
光学代考
光学(Optics),是物理学的分支,主要是研究光的现象、性质与应用,包括光与物质之间的相互作用、光学仪器的制作。光学通常研究红外线、紫外线及可见光的物理行为。因为光是电磁波,其它形式的电磁辐射,例如X射线、微波、电磁辐射及无线电波等等也具有类似光的特性。
大多数常见的光学现象都可以用经典电动力学理论来说明。但是,通常这全套理论很难实际应用,必需先假定简单模型。几何光学的模型最为容易使用。
相对论代考
上至高压线,下至发电机,只要用到电的地方就有相对论效应存在!相对论是关于时空和引力的理论,主要由爱因斯坦创立,相对论的提出给物理学带来了革命性的变化,被誉为现代物理性最伟大的基础理论。
流体力学代考
流体力学是力学的一个分支。 主要研究在各种力的作用下流体本身的状态,以及流体和固体壁面、流体和流体之间、流体与其他运动形态之间的相互作用的力学分支。
随机过程代写
随机过程,是依赖于参数的一组随机变量的全体,参数通常是时间。 随机变量是随机现象的数量表现,其取值随着偶然因素的影响而改变。 例如,某商店在从时间t0到时间tK这段时间内接待顾客的人数,就是依赖于时间t的一组随机变量,即随机过程
Matlab代写
MATLAB 是一种用于技术计算的高性能语言。它将计算、可视化和编程集成在一个易于使用的环境中,其中问题和解决方案以熟悉的数学符号表示。典型用途包括:数学和计算算法开发建模、仿真和原型制作数据分析、探索和可视化科学和工程图形应用程序开发,包括图形用户界面构建MATLAB 是一个交互式系统,其基本数据元素是一个不需要维度的数组。这使您可以解决许多技术计算问题,尤其是那些具有矩阵和向量公式的问题,而只需用 C 或 Fortran 等标量非交互式语言编写程序所需的时间的一小部分。MATLAB 名称代表矩阵实验室。MATLAB 最初的编写目的是提供对由 LINPACK 和 EISPACK 项目开发的矩阵软件的轻松访问,这两个项目共同代表了矩阵计算软件的最新技术。MATLAB 经过多年的发展,得到了许多用户的投入。在大学环境中,它是数学、工程和科学入门和高级课程的标准教学工具。在工业领域,MATLAB 是高效研究、开发和分析的首选工具。MATLAB 具有一系列称为工具箱的特定于应用程序的解决方案。对于大多数 MATLAB 用户来说非常重要,工具箱允许您学习和应用专业技术。工具箱是 MATLAB 函数(M 文件)的综合集合,可扩展 MATLAB 环境以解决特定类别的问题。可用工具箱的领域包括信号处理、控制系统、神经网络、模糊逻辑、小波、仿真等。